Architectures végétales
Description : Dessin en élévation de plusieurs modèles architecturaux.
Provenance des spécimens : Nouvelle-Zélande/Aotearoa, Australie, Nouvelle-Calédonie/Kanaky, Colombie, Chine, France.
Phases effectuées : Recollement et étude du corpus scientifique et universitaire pour chaque espèce.
Relevé sur site, utilisant les techniques employées en restauration des Monuments Historiques (minutes, photographie, drone, laser 2D).
Dessin des troncs/stipes, houppiers et systèmes racinaires représentant différent modèles architecturaux (arboritecture).
Tous dessins en élévation : Axel Aucouturier, 2020-2024
* Nota : All root system drawings are reconstructions, using litterature sources and no proper underground surveys.
The drawings are strictly artistic representations and do not pretend to be a scientific work.
As I kindly allow the non-commercial use of these drawings, please contact me before personal use or publication.
Araucaria Bidwillii, Bunya pine (Araucariaceae family) is native from Queensland, Australia.
This evergreen fast growing conifer can reach up to 30-50 meters tall.
Considered as living fossil from the Jurassic, bunyas live "only" 300 years and are among the most architecturally interesting trees (araucariaceae family shared with ie kauri).
The bole, which can have a diameter of 150cm, is straight and undivided, often free of branches for up to two-thirds of the trees height with very little taper.
Araucaria bidwillii have two types of foliage : the younger or understory needles are narrow, glossy green with a point and are arranged in two rows while mature leaves are stiff with very sharp points and spirally arranged around the branchlets.
A. bidwillii produces very large, spiny female cones up to 60cm long and weighing 5-6 kg !
The cones take two years to mature, and each contains up to a hundred seeds.
These cones were a very important food source for native Australians - each Aboriginal family would own a group of trees and these would be passed down from generation to generation. This is said to be the only case of hereditary personal property owned by the Aborigines. Tribal wars were stopped during the season to organize festivals, climb 50m tall bunyas and harvest the cones.
The trees were then greatly over-exploited by the first European settlers, who felled the vast majority for their timber.
Bunya was highly valued as « tonewood » for stringed instruments’ sound boards.
Few remaining wild stands are now protected in reserves and National Parks and if few subpopulations are still currently threathened in northern Queensland, the main in the South are not.
Its natural habitat are fertile basalt soils in cool and moist valleys at low elevations near the coast. Normally found as an emergent tree over tropical rainforest, in humid areas where mists are frequent.
Agathis australis, NZ kauri, is endemic to the northern part of North Island and surely one of the largest and most complex symbol of Aotearoa / New Zealand.
Agathis genus is part of the architecturaly wonderful Araucariaceae family.
Its is a stout coniferous tree, growing in monoecious forest. Trees normally live longer than 600 years, attain heights of 30 metres with a trunk of 4-7 m in diameter. Although there is a weak relationship between age and diameter : remarkable kauris can live more than 4 500 years, some reach 60m or others have a trunk 20m diam.
Like other large tree species, oldest kauri individuals were sacred for Māoris, being representation of Tāne, the god of forests and birds.
The Māori tradition explains that life came on Earth when the son Tāne spread his father Ranginui - the sky - from Papatūanuku his mother - the earth - who used to lie in a tight embrace where their many children lived in the darkness between them. Oldest trees are so believed to be columns allowing life on Earth.
Modern botany proves kauri forests are among the most ancient in the world, appearing during the Jurassic period (190-135 million years ago). Kauri even act as a foundation species that modify the soil under their canopy to create unique plant communities.
Despite that, 90% of its former range has been burnt or logged since homo sapiens discovered Aotearoa a thousand years ago. With their very straight trunk, younger individuals were used for cultural purposes, such as for making waka (canoes) or other Māori buildings and structures. European settlers intensified the exploitation during the 19th century to make long masts, pieces of structure or furniture exported to Australia, USA and Great Britain.
The flaking bark of the kauri tree defends it from parasitic plants, and accumulates around the base of the trunk. On large trees it may pile up to a height of 2m or more. The kauri has a habit of forming small clumps or patches scattered through mixed forests.
The seed cones are globose, 5 to 7 cm diameter, and mature 18 to 20 months after pollination; the seed cones disintegrate at maturity to release winged seeds, which are then dispersed by the wind. A single tree produces both male and female seed cones. Fertilisation of the seeds occurs by pollination, which may be driven by the same or another tree's pollen.
In terms of local topography, kauris usually grow on the slope of the land. Water on hills flows downward by the action of gravity, taking with it the nutrients in the soil.
One of the defining aspects of the kauri trees's unique ecological niche is its relationship with the soil below. Much like podocarps, it feeds in the organic litter near the surface of the soil through fine root hairs. Although its feeding root system is very shallow, it also has several downwardly directed peg roots which anchor it firmly in the soil.
The litter left by kauri is much more acidic than most trees, and as it decays similarly acidic compounds are liberated. In a process known as leaching, these acidic molecules pass through the soil layers with the help of rainfall, and release other nutrients trapped in clay such as nitrogen and phosphorus. This process called podsolization leaves the important nutrients unavailable to other trees, as they are washed down into deeper layers.
Leaf litter and other decaying parts of a kauri decompose much more slowly than those of most other species. Besides its acidity, the plant also bears substances such as waxes and phenols, most notably tannins, to protect from harmful microorganisms.
As with most perennials, these feeding roots also house a symbiotic fungi known as mycorrhiza which increase the plant's efficiency in taking up nutrients. In this mutualistic relationship, the fungus derives its own nutrition from the roots. In its interactions with the soil, kauri is thus able to starve its competitors of much needed nutrients and compete with much younger lineages.
A. Australis was not strictly regarded as threatened until recently when was identified the kauri fungus dieback (Phytophthora taxon Agathis) which causes the death of kauri trees spread by underground root-to-root contact, and human and animal vectors.
Kauri species are found in the Pacific regions from Malaysia, Philippines, Melanesia, Australia, New Caledonia to New Zealand where Australis is the most southernmost specy of the Agathis genus.
This solitary specimen is more than 60 years old and was found in Hauraki Gulf, New Zealand.
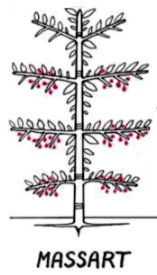
Agathis australis, like many species from the Araucariaceae family, changes its architectural model throughout its lifetime : juvenile and adult specimens follow the Massart's model then gradually changes to Rauh model when fully matured.
Modèle architectural de Massart : groupe rythmique et branches horizontales. 2 Fromager Ceiba pentandra. 4 Noix de muscade. (dessin Francis Hallé)
Araucaria heterophylla / Araucaria excelsa, Norfolk pine (Araucariaceae family).
Specimen found and drawn in Auckland region, New Zealand.
“ General taxonomic notes on Araucariaceae : Three genera with 41 known species. The genera include : Agathis, Araucaria & Wollemia.
Some authors elevate the family to the level of an order, Araucariales (Heintze,1927). Relationships within the family were long contested, but were finally elucidated by genetic analyses (Setoguchi et al. 1998, Escapa and Catalano, 2013). Phylogenetic trees for these analyses agree that all three genera are monophyletic and that Wollemia, sister to Agathis, is the most primitive of the three.
Within Araucaria, the four sections previously recognized (Araucaria, Bunya, Eutacta, and Intermedia) are supported, but relationships within Agathis remain somewhat unclear; A. australis of New Zealand is basal, and the four New Caledonian species are sister to a clade containing all remaining species.
"The New Caledonian Araucaria and Agathis species each formed a monophyletic group with very low differentiation in rbcL sequences among them, indicating rapid adaptive radiation to new edaphic conditions, i.e., ultramafic soils, in the post-Eocene era" (Setoguchi et al. 1998). A possible phylogenetic tree is here reproduced (Kershaw and Wagstaff 2001, modified from Setoguchi et al. 1998; note that one new species, Araucaria goroensis, has since been described in Section Eutacta). ” Christopher J. Earle, The Gymnosperm Database, 2020
Schéma du modèle architectural de Massart (dessin Francis Hallé)
Araucaria heterophylla known as Norfolk pine (although it is not a true pine) is endemic to Norfolk Island, a small Australian island between New Zealand and New Caledonia.
It is a slow growing tree that can reach a height of 50–65 m.
From the straight vertical trunk, it emits its branches almost horizontal or slightly oblique, in number of five, forming floors; the plane of each floor is a perfect pentagon.
The scientific name heterophylla ("different leaves") derives from the variation in the leaves between young and adult plants.
This young adult specimen of Araucaria heterophylla was found in Aotea, Great Barrier Island, Hauraki Gulf (east of Auckland), New Zealand.
Araucaria genus trees, like Abies, show the particularity of changing their architectural models during their growth : they pass from Massart to Rauh when their are ageing.
Aciphylla Scott-thomsonii / Taramea / Giant speargrass or spaniard. Colony of 3 individuals in Hooker valley (Mount Cook National Park, NZ).
Scott-thomsonii is endemic to the Southern Alps of South Island in montane grassland. It is the largest Spaniard with a spike of yellow flowers up to 3-4 meters tall.
With about 40 species the genus Aciphylla, is one of the larger genera of New Zealand flowering plants where it is mostly confined.
The name aciphylla comes from the Latin acicula ‘needle’ and the Greek phyllum ‘leaf’, meaning needle-leaf.
Some aciphyllas are massive plants with leaves so sharp and rigid that they have the ability to run right through flesh if fallen upon, and it is reported that walkers have perished after losing their footing on a mountain slope and falling on the inflorescences.
They are genetically close to the carrot, celery, fennel, annise, caraway or coriander. Some other cousins are very poisonous like hemlock, which was used by ancient Athenians for the sentenced to death (e.g. Socrate).
Māori tribes had a special relationship with taramea (A. S-Thomsonii, A. Colensoi, A. Aurea, A. Squarrosa). It is a taonga species – a sacred treasure and highly valued. The young tap-root is edible, somewhat like a carrot but traditionally, long, stiff and pointed leaves were gathered by hand, plaited, and heated over a fire during many days to extract a highly aromatic and balsamic resin. The gum of taramea was mixed with animal fat such as refined kererū (NZ pigeon) or tītī (muttonbird) to make fragrant sachets of oil. Such was its value that it was used as currency in trade for food, pounamu (greenstone), and as gifts between chiefs as it was used as an ingredient in scent for their clothing.
The leaves are divided three times with long pointed final segments. Its fibre was used as a kind of sandal and galligaskin (half-legging) combined made by a netting process from the plant. Called tūmatakuru, they were folded over the foot and above the ankle and laced on, being stuffed or lined with rimurimu (moss). Used by the Tūhoe tribe, usually for traversing the Te Urewera snow-clad ranges in winter.
Image left : Spikes from protecting flowers on the inflorescence mast. Probably Aciphylla Aurea (or maybe A. Colensoi) in Travers Sabine, Nelson Lakes, New Zealand.
Phormium tenax, Harakeke, NZ flax is a coastal cover, evergreen perennial plant native to New Zealand and Norfolk Island.
The plant grows as a fan-like bases, clump of long, straplike leaves, up to 2 metres long, from which arises a 5 metres inflorescence with dramatic yellow or red flowers.
Phormium tenax leaves had many uses in traditional Māori society. They were woven to make shoes, baskets or soft and durable fabric for clothing.
It is also a symbol of the whānau (family) in Māori thought : the younger leaf is the rito (“child”) rising in the center. It is protectively surrounded by the awhi rito (“parents”). The outside leaves represent the tūpuna (“grandparents and ancestors”) leaning and soon returning to earth.
Specimen found in Medlandsbeach on Aotea, Great Barrier Island, New Zealand.
(Macro)Piper excelsum known as kawakawa is found in both New Zealand and the Society Islands (Tahiti).
It is an important plant in Māori tradition and aptly known as “the pharmacy of the forest” or “the plant of the heart” due to its heart-shaped leaves and tonic effect on cardiovascular system.
The roots of the plant are used to produce a drink with medicinal, sedative, anesthetic, euphoriant, and entheogenic properties. An infusion is made from the leaves or roots, and used for bladder problems, boils, bruises or to relieve pain or toothache.
The sweet edible yellow berries (most often found in summer on female trees) of the plant were eaten as a diuretic by humans, kererū (NZ pigeon, Hemiphaga novaeseelandiae) and tuī (Prosthemadera novaeseelandiae). The leaves are often covered with holes caused by the caterpillar of the kawakawa looper moth. Māori understood that these particular leaves have a stronger effect as the plant is protecting its leaves from "bleeding". It means that more holes more fun.
The name kawakawa refers to the bitter taste of the leaves (kawa : bitter). More generally, kawa means "ceremonial protocol", recalling the stylised consumption of kava (Piper methysticum) the drug typical of Polynesian societies.
Kawakawa is also important in cultural contexts : it was used to welcome guests at the marae (communal social and religious place). At a tangi (funeral), both hosts and guests may wear wreaths of kawakawa on the head as a sign of mourning.
From a botanical point of view, Piper excelsum is endemic to New Zealand and is from the same family as the asian black pepper that we use as a condiment.
Its architecture is also interesting with prominent nodes at angles where the branches divide (much more visible than on the other vines of the Piper family that usually grow on other trees).
This young specimen was found in Abel Tasman National Park, North of South Island New Zealand.
Cordyline australis, Tī kōuka, Cabbage tree is an important spiritual icon in Maori culture.
As it commonly found to stand alone on swampy and muddy grounds it is a symbol of creativity and bravery. It is important in both birth (placentas were buried at its foot) and death (North Māori tribes believes that the spirits of the dead rest in the tī, the crown).
The inner parts of the younger leaves are commonly eaten raw or cooked and taste like cabbage.
This specimen was observed in a particular place as it is believed that Aotea / Great Barrier Island was the first island of the New Zealand archipel to be discovered by homo sapiens.
Schéma du modèle architectural de Corner (dessin Francis Hallé)
Rhopalostylis sapida, nīkau palm, is the only palm species endemic to mainland New Zealand.
Its natural range is protected coastal and wet lowland forest on all the North Island and on the South Island as far south as Banks Peninsula.
It occurs on Chatham Island and Pitt Island/Rangiauria where it is the world's southernmost palm at 44° 18'S latitude.
The nīkau is very slow-growing but can go up to 15 m tall. It takes 40-50 years to begin to form a trunk and about 200 years to reach 10 m tall.
It is easy to recognise in the bush with its circular trunk, which is ringed with evenly spaced scars from fallen leaves. The trunk is topped by a typical green & smooth bulging crownshaft up to 1m long. On average two fronds are shed per year leaving behind a leaf scar on the trunk which can be used to give a rough indication of age since the trunk began forming.
The inner leaves and the young flower clusters can be eaten raw or cooked. Māori usually wrapped their food in the leaves for cooking, and used old fibrous leaves to make strong baskets, floor mats, and waterproof thatch for buildings.
The nīkau is closely related to the betel nut, the seeds of which are used as a laxative. The centre shoots of nīkau can be used in the same way.
These 2 specimens are about 35 years old, observed in Parnell, Auckland, Hauraki Gulf, New Zealand.
Rhopalostylis sapida, like many other palm trees, belongs to the Corner architectural model : few but large leaves with sexuality on the side of the trunk. a single orthotropic axis (monocaule) with lateral sexuality which allows indefinite growth of the vegetative axis. Trees of the Corner model have no branches, but the single axis can in some species bear repetitions. For example the apparent “branches” of Carica papaya tree are actually smaller reproductions of the main axis.
Archontophoenix alexandrae, known as King palm, is native to the wet areas of north eastern Queensland, Australia.
The name Archontophoenix is the combination of the greek 'Archontos' which means chief magistrate and of the name of the palm Phoenix.
Its specific name is dedicated to Alexandra of Denmark (1863-1910) wife of King Edward VII, son of Queen Victoria.
It is a solitary palm, slightly enlarged at the base, that grow up to more than 25 m tall with about 18 cm of diameter, of green colour in the youngest part, grey in the oldest, on which are visible the rings trace of the junction of the fallen leaves.
This young specimen was found in Medlands beach, on Aotea / Great Barrier island, in Hauraki Gulf, New Zealand.
Washingtonia filifera (or perhaps A. filifera here), also known as Californian fan palm is native to the far southwestern United States and Baja California.
Filifera means “thread-bearing” and the it can grow to 15–20 m.
When the fronds die, they usually remain attached and drop down to cloak the trunk in a wide skirt.
The shelter that the skirt creates provides a micro-habitat for many small birds and invertebrates.
This specimen was found in Alberon reserve in Parnell, Auckland, New Zealand.
Un bouleau présente un système racinaire bien connu: comme presque toutes les espèces végétales, le bouleau absorbe l'eau et les sels minéraux contenus dans le sol grâce à l'association de ses racines avec le mycélium de certaines espèces de champignons. Des orchidées, disposées au fond de la salle, exhibent des racines chlorophylliennes qui leur permettent de capter l'eau atmosphérique et les sels minéraux contenus dans les matières en décomposition piégées dans les ramures des arbres. A droite, des Tillandsia vivant sans aucun sol ne présentent pas de racines : les poussières atmosphériques, ainsi que l'eau qui se condense ou ruisselle sur les plantes, sont directement absorbées par les feuilles.
Exposition de Pascal Cribier, “ Les Racines ont des feuilles ”, Espace Electra, fondation EDF, Paris, 2008.
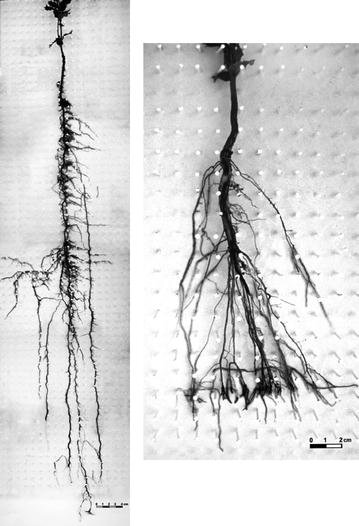
Quercus ilex L. Morphologic variability in the root systems of the same age subjected to different rooting environments. Left, seedling grown in a 100 cm deep container ; Right, seedling grown in a 20 cm deep container.
Quercus cerris. Root system growing on a plane ground with 3D modelization.
Piper methysticum (Pacific kava) root system.
Phormium tenax (New Zealand flax, Harakeke) root system diagram.
Cordyline australis (NZ Cabbage tree, ti kouka, tītī). Root system close-up view.
Francis Hallé " Des feuilles souterraines ? "
in Pascal Cribier, Itinéraires d'un jardinier, Éditions Xavier Barral, 2009, p.132 (tous droits réservés aux auteurs et à l'éditeur)
“ Fin du XVIIIe siècle. Le grand botaniste Goethe découvre que les plantes sont faites de trois types d'organes, d'abord les tiges, puis les feuilles portées par les tiges et spécialisées dans les échanges avec le milieu, et enfin les racines qui assurent la fixation au sol. Ces organes sont-ils peu nombreux? On a une petite herbe, primevère, violette ou œillet. Se répètent-ils en très grand nombre ? Cela permet la croissance des arbres, hêtre, manguier ou séquoia. Ce que disait Goethe reste valable aujourd'hui: aussi vaste et complexe que puisse être la structure d'une plante, il est toujours possible de la résoudre en trois constituants - pas un de plus - tiges, feuilles et racines. Même les fleurs et les fruits n'y échappent pas !
Fin du XXe siècle. Une idée presque incroyable se fait jour, à laquelle l'auteur de Faust aurait eu bien du mal à adhérer. Les travaux de nombreux chercheurs, botanistes et paléobotanistes, forestiers et agronomes, convergent vers ce résultat surprenant: les racines, elles aussi, portent des feuilles! Des feuilles souterraines, qui naissent et «tombent» en même temps que les feuilles vertes aériennes que nous connaissons tous. On comprendra que je mette des guillemets à «tombent» : elles ne peuvent pas réellement tomber puisqu'elles sont déjà sous terre ...
Racines longues, racines fines.
Les systèmes racinaires de deux arbres très différents l'un de l'autre, le chêne et le cocotier, ne se ressemblent pas du tout, comme on pouvait s'y attendre. Pourtant ces deux systèmes ont une curieuse propriété en commun: ils font coexister deux types de racines.
Les « racines de structure », appelées aussi « racines longues » parce que leur fonction principale, outre l'ancrage mécanique, est d'explorer le sol sur de grandes distances, pouvant atteindre des dizaines de mètres. Les racines de structure ont une vie longue, parfois aussi durable que celle de l'arbre lui-même ; pendant cette longue vie, elles deviennent dures- on dit qu'elles se lignifient- et augmentent en diamètre, au moins dans le cas du chêne. On l'aura compris, une racine de structure est, en milieu souterrain, l'équivalent de ce qu'est une branche dans la partie aérienne de l'arbre.
Les «racines fines » sont issues des précédentes ; leur rôle est d'exploiter le sol en absorbant l'eau et les sels minéraux disponibles. Ces racines fines ne dépassent pas une dizaine de centimètres de longueur; elles ont une vie courte, parfois réduite à quelques semaines; elles sont incapables de se lignifier et leur diamètre n'augmente jamais. Elles ont donc plusieurs caractères qui, de toute évidence, rappellent ceux des feuilles.
Est-illégitime de considérer ces « racines fines » comme des feuilles souterraines ? J'ai réuni des arguments qui vont dans les deux sens afin que la discussion permette au lecteur de se faire une idée aussi objective que possible.
La première question à aborder est celle de l'origine des« racines fines». D'où proviennent-elles ? Comment font-elles leur apparition sur la plante ?
Les « racines fines », d'où proviennent-elles ?
En comparant la naissance des feuilles à l'extrémité d'une tige en crois- sance, et la naissance des « racines fines » à l'extrémité d'une «racine de structure » en croissance, on constate aisément que, pour l'essentiel, les deux mécanismes sont identiques. La séquence des événements- période embryonnaire, naissance, développement, période d'activité intense, sénescence, disparition- est la même dans les deux cas.
Mais la question n'est pas résolue pour autant, car il existe au moins trois différences entre nos deux organes:
- Les feuilles prennent naissance à la surface de la tige, tandis que les «racines fines » sont issues des tissus internes de la « racine de structure ». Mais cela s'explique ; il faut y voir l'effet de la contrainte majeure qu'affrontent toutes les racines: croître à travers un milieu dense et hétérogène, ce qui oblige à protéger de l'abrasion les tissus les plus fragiles, donc les plus jeunes. La «Coiffe », à l'extrémité de la racine de structure, répond au même impératif de résistance à l'abrasion.
- Les feuilles apparaissent sur la tige en des positions prévisibles, selon un ordre strict, d'une rigueur mathématique, connu sous le nom de phyllotaxie. Les «racines fines » apparaissent, au contraire, de façon opportuniste ou aléatoire: il ne semble pas exister de «rhizo-taxie ».Mais on connaît aussi quelques (rares) exemples de feuilles à phyllotaxie aléatoire, et ce caractère ne sépare donc pas profondé- ment nos deux organes.
- Les nervures des feuilles sont le plus souvent réunies entre elles en une surface plane et active en matière de photosynthèse, le limbe. Les « racines fines », bien sûr, n'ont pas de limbe, mais cela n'empêche pas d'y voir des feuilles, puisque les feuilles du cabomba, non plus, n'ont pas de limbe, ni celles du fenouil.
Si les feuilles et les «racines fines » apparaissent et se mettent en place de la même manière, peut-être leurs fonctions sont-elles à ce point différentes que cela les sépare définitivement? Quelles sont donc les fonctions des « racines fines » ?
Les « racines fines », à quoi servent-elles ?
Ont-elles des fonctions qui les rapprochent des feuilles classiques, ou qui les en éloignent ? Les feuilles, en principe, contiennent de la chlorophylle et, à la lumière, réalisent la photosynthèse des sucres. Les «racines fines », quant à elles, n'en contiennent pas ; d'ailleurs la chlorophylle ne leur servirait à rien puisqu'elles vivent dans le noir, sous la terre. Ce caractère séparerait ces deux organes si l'on ne disposait pas des exemples de la pomme de terre, des iris, des lis, des oignons et de beaucoup d'autres plantes, dont les tiges peuvent être souterraines, donc porter des feuilles elles aussi souterraines : réduites à l'état d'écailles, ces feuilles-là ne contiennent pas de chlorophylle. À l'inverse, on rencontre aussi des racines aériennes, chez les orchidées par exemple : ces racines-là sont vertes et, à la lumière, synthétisent des sucres ! Les «racines fines», comme toutes les racines, servent à absorber l'eau dont la plante a besoin et, a priori, c'est là un rôle très différent de la fonction chlorophyllienne classiquement dévolue aux feuilles. Mais dans les faits, les fonctions ne sont pas aussi distinctes que le dit la botanique classique. Nous venons de voir le cas des racines vertes qui synthétisent des sucres ; la contrepartie existe : les feuilles aériennes sont souvent capables d'absorber de l'eau, les poils qu'elles portent pouvant avoir la fonction de poils absorbants. Il est regrettable que si peu de travaux expérimentaux aient analysé cette question de l'absorption de l'eau et des éléments dissous par les feuilles; mais la réalité de cette absorption ne peut être mise en doute, puisqu'on utilise avec succès, en horticulture, des «engrais foliaires».
Outre l'absorption d'eau, les «racines fines » ont une autre fonction, très originale et d'une profonde signification biologique : elles peuvent entrer en symbiose avec des champignons du sol pour former des mycorhizes. C'est un domaine d'une telle importance, et qui suscite actuellement des recherches si nombreuses, qu'il est justifié de lui accorder quelques instants d'attention. Je rappelle que les champignons ne sont pas des plantes, et qu'ils constituent un groupe d'êtres vivants particuliers, proches des animaux.
Symbiose entre « racines fines » et champignons
Alors que les «racines de structure » ne sont pas concernées par le phénomène, plus de 90% des plantes ont leurs «racines fines» colonisées par des champignons du sol- qui peuvent être des truffes par exemple - ce qui conduit à la formation de mycorhizes, des organes mixtes dont les recherches actuelles découvrent les fonctions de plus en plus nombreuses.
La mycorhize assure la nutrition des deux partenaires: la plante nourrit le champignon en lui fournissant des aliments carbonés et, en retour, le champignon apporte à la plante de l'eau, des sels minéraux- potassium, phosphore- et de l'azote. Étant capable de prospecter de grands volumes de sol, grâce à ses filaments qui atteignent un mètre de longueur, le champignon assure un apport nutritionnel décisif, au point que l'agronomie expérimentale envisage de remplacer les engrais par... des champignons du sol !
Cette fonction nutritionnelle n'est pas la seule qu'assure la mycorhize. Elle protège aussi la plante contre ses pathogènes, par exemple en émettant des antibiotiques, ou contre des sécheresses temporaires en accroissant le volume de sol prospecté. Les filaments mycéliens étant parfois très longs, un même champignon peut s'associer aux «racines fines » de nombreuses plantes, souvent d'espèces différentes. On assiste ainsi à une mise en réseau aux conséquences inattendues. Des molécules carbonées peuvent être transférées d'une plante à l'autre par un même champignon mycorhizien : des plantes de sous-bois, manquant de lumière, peuvent se nourrir aux dépens des arbres qui les entourent et qui leur font de l'ombre.
La mycorhize peut aussi modifier la forme de la plante qui l'abrite, en agissant sur la masse de ses tiges, de ses racines, ou de ses feuilles. On en arrive au concept de «phénotype étendu», une part du phénotype de la plante qui n'est pas contrôlée par son génome, mais par des interactions fortes avec son champignon symbiote. Ces influences majeures sont rendues possibles par la très grande ancienneté des mycorhizes, vérifiée par l'étude des fossiles ; si les plantes ont pu sortir de l'eau et s'installer sur la terre ferme, peut-être est-ce grâce à leurs mycorhizes ?
L'importance des «racines fines » dans le domaine des échanges avec le milieu se trouvant largement confirmée, par le biais des symbioses mycorhiziennes, il reste à vérifier si d'autres arguments amènent à les considérer comme des feuilles souterraines. L'un des points qui retient l'attention est que leur vie est synchronisée avec celle des feuilles qui vivent à la lumière.
Naissance au printemps, mort à l'automne
Tout le monde sait cela, les feuilles aériennes ne vivent que peu de temps ; elles tombent à l'automne en laissant sur la tige une cicatrice bien reconnaissable. Cette vie brève est due au fait qu'il leur manque le tissu qui fonde la longévité chez beaucoup de plantes : le bois. Les feuilles, contrairement à la tige qui les porte, n'en forment pas. Les anatomistes étudiant les structures internes des arbres à bois - chêne, sapin, acajou, baobab ou cerisier - donnent cette interprétation : les feuilles vivent peu de temps parce qu'elles ne disposent pas du groupe de cellules embryonnaires, ou cambium, qui fabrique du bois.
Comme les feuilles aériennes, les « racines fines » n'ont pas de cambium et ont donc une vie courte, le plus souvent inférieure à un an ; leur longévité étant toutefois accrue par la présence de mycorhizes. À l'automne, lorsque tombe le feuillage aérien, toutes les «racines fines» d'une même plante, au moins celles qui ne sont pas mycorhizées, meurent, se dessèchent et disparaissent ; cela diminue l'absorption d'eau, mais ne l'arrête pas totalement puisque les parties jeunes des« racines de structure» continuent à absorber l'eau. La plante n'ayant que des besoins hydriques modérés en automne et en hiver, la disparition de la plupart de ses «racines fines » est sans conséquence. On estime cette perte automnale des «racines fines » à 30% de la masse racinaire totale.
Au printemps, lorsque s'ouvrent les bourgeons dans la cime de l'arbre, de nouvelles « racines fines » se mettent en place. Il est vraisemblable que les deux phénomènes ne sont pas vraiment synchrones, mais les recherches effectuées sur des chênes à feuillage caduc ont jusqu'à présent échoué à mettre en évidence une quelconque chronologie. Quoi qu'il en soit, les nouvelles « racines fines » assurent la puissante alimentation en eau qui est indispensable à la croissance du jeune feuillage printanier. Un point intéressant est que cette dynamique saisonnière des « racines fines » - naissance au printemps, mort à l'automne - se maintient chez les chênes à feuillage persistant, par exemple le chêne vert.
On le constate, les structures anatomiques, de même que les rythmes annuels de naissance et de mort, montrent de belles analogies entre ces deux organes que sont les «racines fines» et les feuilles. Un détour par la paléobotanique - botanique des plantes anciennes et disparues, que nous ne connaissons que par leurs restes fossilisés -, va nous révéler des analogies encore plus poussées.
Des feuilles souterraines chez des plantes fossiles
Changement complet d'époque et de décor. Nous sommes au carbonifère, il y a 350 millions d'années : l'Europe et l'Amérique du Nord sont soudées en un continent unique, sous un climat équatorial, donc très humide. Le paysage est étrange, fait de vastes et luxuriantes forêts marécageuses qui devaient ressembler au Pantanal actuel (sud du Mato Grosso brésilien) ou aux marais d'Irian Jaya (Nouvelle-Guinée indonésienne). Au-dessus des marais volent des libellules Meganeura d'un mètre d'envergure et, dans le sous-bois, rampent des mille-pattes Arthropleura qui atteignent 1,80 mètre de long. Les arbres sont des isoétales, qui dépassent 40 mètres de hauteur et 2 mètres de diamètre à la base; selon la position de leurs sporanges, on les appelle Sigillaria, Chaloneria, Lepidophloios ou Lepidodendron. Leurs descendants actuels sont de petites herbes des marécages, les Isoetes.
Une isoétale arborescente s'accroît simultanément vers le haut et vers le bas, à partir d'un organe central nommé Stigmaria, une sorte de souche ressemblant à la fois à une tige et à une racine. Les branches, dans la couronne de l'arbre adulte, sont identiques aux « racines de structure » du Stigmaria. Dans ses parties souterraines, ce dernier porte des « racines fines » qui ont toujours été considérées comme des feuilles souterraines puisqu'elles sont identiques à ces dernières : elles sont dépourvues de cambium, leur vie est courte et, lorsqu'elles se détachent elles laissent des cicatrices à dispositions régulières ; en d'autres termes la rhizotaxie est bien visible. L'étude de ces isoétales arborescentes du carbonifère nous conduit à une vision nouvelle de la plante, très surprenante et aussi - de mon point de vue - très poétique.
La surface du sol, comme un miroir...
Selon cette conception, la surface du sol joue, en quelque sorte, rôle d'un miroir, de part et d'autre duquel les structures se déploient à l'identique, des branches portant des feuilles en haut, des « racine de structure » portant des « racines fines » en bas. Cette symétrie par rapport à la surface du sol était évidente au carbonifère ; mais le sol et l'air sont des milieux si différents, et les plantes ont évolué pendant des durées si longues, que la symétrie ne subsiste plus que dans le indices ténus qui ont été discutés ici.
Pour moi, en effet, l'argument fourni par les fossiles lève les derniers doutes : les « racines fines » de nos plantes actuelles sont bien de feuilles souterraines. Elles ont beaucoup en commun avec les feuilles aériennes : apparition à proximité du sommet d'un axe de structure intense activité dans le domaine des échanges avec le milieu extérieur, anatomie simplifiée sans cambium, absence de bois, dimensions réduites et vie brève, d'ailleurs synchronisée avec celle des feuilles aériennes. Ces deux types de feuilles se complètent au plan fonctionnel : celles du bas envoient de l'eau à celles du haut, qui, en retour, fournissent à celles d'en bas une alimentation carbonée, riche en énergie.
Goethe, qui ignorait la paléobotanique, ne pouvait pas prévoir l'existence de ces feuilles souterraines. Deux siècles plus tard, nous tenons là une authentique idée neuve dans le domaine de la forme des plantes. ”
Sources, références et bibliographie :
John Wyndham Dawson & Rob Lucas, Field Guide to New Zealand's Native Trees, Potton & Burton, 2012.
Lore Kutschera & Erwin Lichtenegger, Wurzelatlas mitteleuropäischer Waldbäume und Sträucher. Leopold Stocker Verlag (Graz, Stuttgart), 2002 (2. Aufl. 2013).
See researches and drawings in the Wageningen University collection
Atlas des systèmes racinaires (Institut de sociologie végétale)
John Ernest Weaver, The ecological relations of roots, 1919 : Roots of 140 species native plants from desert climates.
Yoav Waisel, Amram Eshel & Uzi Kafkafi, Plant Roots, The hidden half (2nd and 3rd Editions), Marcel Dekker Inc. (New-York), 1996
W.Böhm, Methods of Studying Root Systems, Springer-Verlag Berlin and Heidelberg GmbH & Co. K (1 juillet 1979)
Auckland University library (New Zealand), shelves Botany and Root (Biology 581.498)
Victoria University of Wellington Library
arboritecture.org : Référence des thèses, articles, vidéos, etc. autour des principes de Structure/Architecture des arbres (cf. Daniel Barthélémy, Claude Édelin, E. J.H. Corner, Christophe Drénou, Francis Hallé, Roelof A.A Odlerman, Jeanne Millet, etc).
Francis Hallé, Éloge de la plante. Pour une nouvelle biologie, Seuil, 1999.
Francis Hallé, 50 ans d'explorations et d'études botaniques en forêt tropicale, Museo, 2016. Préface de Patrick Blanc.
Francis Hallé, 50 ans d'observation de jardins botaniques dans le monde, Museo, 2016, Préface de Gilles Clément.
Francis Hallé, 30 ans d'exploration des canopées forestières tropicales, Museo, 2017, Préface de Hubert Reeves.
Stefano Mancuso & Alessandra Viola, L'Intelligence des plantes, Albin Michel, 2013.
Jeremy Narby, L’intelligence dans la nature : En quête du savoir, Buchet/Chastel, 2017.
Handbooks of the Flora of Papua New Guinea, Vol. 1, Edited by John Womersley, Melbourne University Press, 1978
Handbooks of the Flora of Papua New Guinea, Vol. 2, Edited by E. E. Henty, Melbourne University Press, 1978
Handbooks of the Flora of Papua New Guinea, Vol. 3, Edited by Barry J. Conn, Melbourne University Press, 1978